Vad är så viktigt med kväve?
 I den mänskliga ekonomins värld, politik, och samhället, det finns många olika valutor, som alla handlas mot varor. Detta kan vara olja, US dollar, Facebook-gilla eller mormors kakor. Den naturliga världen har liknande valutor - handel med syre, kol, och kanske den mest värdefulla valutan av alla: kväve .
I den mänskliga ekonomins värld, politik, och samhället, det finns många olika valutor, som alla handlas mot varor. Detta kan vara olja, US dollar, Facebook-gilla eller mormors kakor. Den naturliga världen har liknande valutor - handel med syre, kol, och kanske den mest värdefulla valutan av alla: kväve .
Hela världen kämpar för det, skörda det ärligt, fusk för det, och stjäl den brutalt. Det är ett kraftfullt element, krävs i de högsta kvantiteterna för god tillväxt, försvar, och reproduktion. Den här artikeln kommer att täcka vad kväve är, var det förekommer i systemet, och hur det interagerar med de andra elementen i aquaponics. Vi kommer också att diskutera hur man identifierar en kvävebrist.
Kväve i akvaponik
Som jag redan har nämnt, kväve är ett av de viktigaste näringsämnena i ditt akvaponiska system. Det förekommer i flera former i den naturliga världen, men för nu, vi kommer att fokusera på det mest relevanta:protein.
Protein är byggt av aminosyror, som själva är byggda av kväve. Alla växter och djur innehåller proteiner, och när de dör, andra organismer konsumerar dem och rensar dessa proteiner för energi. Således, kväve kommer in i kroppen i form av proteinhaltig mat.
Kvävets kretslopp
När landdjur konsumerar proteiner bryter de så småningom ner dem till aminosyror och sedan till ammoniak. Ammoniak (NH3) är otäcka saker – det är väldigt giftigt – och det bästa sättet att bli av med överflödig ammoniak är att utsöndra det. Så, hos landdjur, ammoniak omvandlas till en kemikalie som kallas urea och utsöndras i urinen.
Kväve förekommer i akvaponiska system på ungefär samma sätt. Det kommer in i form av fiskfoder. Fisken konsumerar maten men processen är enklare; mikroberna i magen bryter ner proteinerna till ammoniak och ammonium. Ammoniak finns vanligtvis som ammonium (NH4+) som rör sig över fiskens cellmembran och så småningom diffunderar ut i vattnet. Ingen extra konvertering behövs. För fisk, i alla fall.
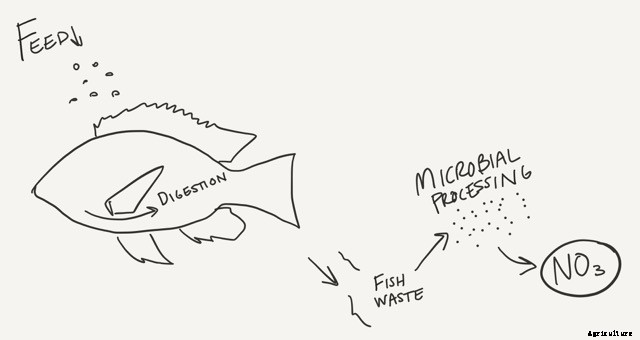
Beroende på ditt vattens pH, ammonium kan förbli ammonium eller förvandlas till ammoniak, vilket kan vara mycket farligt. Ammoniak har ingen laddning, så fisken har svårt att hålla den borta från sina kroppar. När detta händer, fisken är förgiftad.
Så, när ammoniak är i lösningen, den måste förvandlas eller så kommer den så småningom att döda fisken. Det finns två sätt att göra detta:ändra ditt pH för att gynna ammonium (vilket inte rekommenderas) eller omvandla ammoniaken till nitrater. Serien av omvandlingar från en organisk form (ammoniak) till en växttillgänglig form (nitrat) – och nästa steg i cykeln – kallas nitrifikation.
Nitrifikation
Nitrifikation är den process som driver de flesta akvaponiska system. Väsentligen, nitrifikation omvandlar ammoniak och ammonium till nyttigt nitrat. Detta sker i två processer:att omvandla ammoniak till nitrit, och omvandla nitrit till nitrat.
I nästan alla miljöer (utom anaeroba miljöer) omvandlas ammoniak snabbt till nitrit (NO2-). Mikrober – eller nitrifierande bakterier - i jorden eller lösningen tillsätt syre till (eller oxidera ) ammoniaken. Medan detta händer, mikroberna får energi att fixera kol (bryta av kol från koldioxid för att bygga celler). Dessutom, vätejoner (H+) produceras – just de joner som mäts i pH-testet och gör att vattnet blir surt.
Denna process har traditionellt tillskrivits en bakterie som kallas Nitrosomonas. Ny forskning visar att det finns många hundra, om inte tusentals olika arter förutom Nitrosomonas som också gör detta arbete.
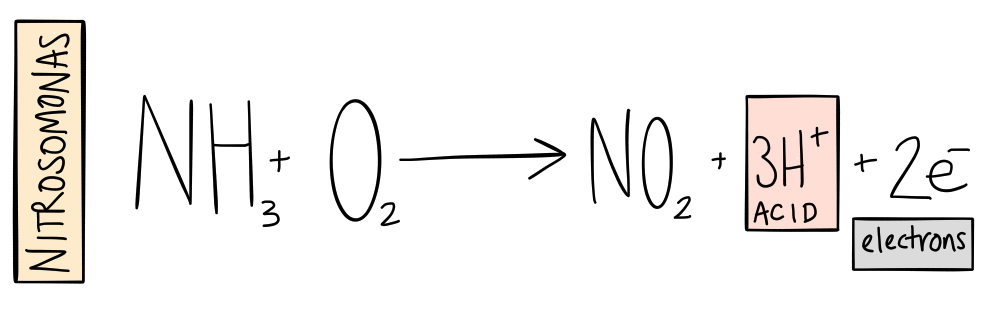
Det är steg ett.
Nästa steg i cykeln är att omvandla den nitriten till nitrat. Nitrit är också ganska giftigt så du vill aldrig ha för mycket i ditt system. Lyckligtvis, det representerar mycket lagrad energi för andra [nitrifierande] bakterier. Dessa bakterier oxiderar nitriten och använder energin från processen för att fixera mer kol. Låter bekant, förutom den här gången är resultatet nitrat (NR 3-). Nitrat är en relativt ogiftig form av kväve som växter kan ta upp och använda för att bygga celler.
Den bakterie som oftast har känts igen för att utföra denna kemiska reaktion kallas Nitrobacter. På nytt, dock, forskning tyder på att det finns många bakterier som deltar i denna reaktion förutom Nitrobacter.
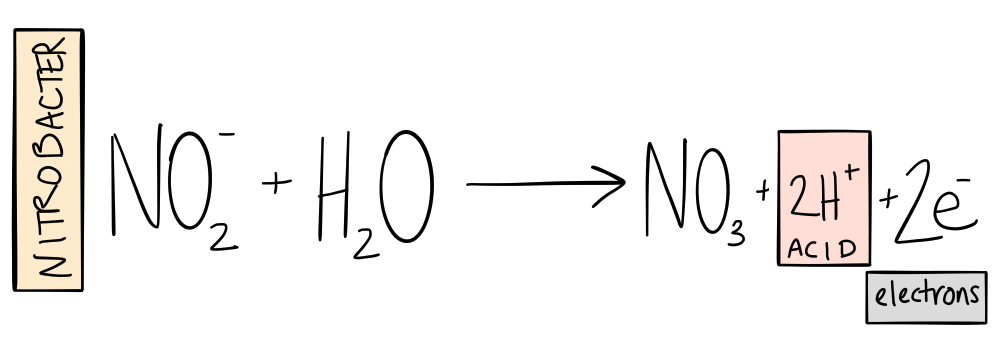
Eftersom bakterierna oxiderar ammoniak och nitrit, de släpper ut hydroniumjoner i lösningen, gör systemet surare. (För personer som vill köra sina system i det optimala pH-intervallet för tillgång till näringsämnen, nitrifikation är den enskilt viktigaste processen för att sänka pH). Detta indikerar varför lösningen av äldre system trendar mot surare pH-värden.
Kväve är tillgängligt med ett brett antal pH-värden - så pH spelar mindre roll när det gäller kvävetillgång.
"...nitrifikation är den enskilt viktigaste processen för att sänka pH."
Nitrifikationseffektivitet och pH
Den hastighet med vilken pH i en lösning ändras, dock, kan påverka formen av tillgängligt kväve (se videon om ammoniak/ammonium och pH) samt effektiviteten av nitrifikation. Om nitrifierande bakterier inte får tid att anpassa sig till ändrade pH-nivåer (som nästan alla andra systemvariabler), nitrifikation kommer att lida.
Faktiskt, nitrifiering går bra vid låga pH-värden så länge som den nitrifierande ekologin får tid att anpassa sig. Nitrifierande bakterier är i allmänhet ineffektiva när det gäller att ändra systemvariabler. De dör ofta eller blir vilande när de utsätts för för mycket ljus, temperaturfluktuationer, fluktuationer i salthalt och pH, såväl som många andra förändringar av deras miljö.
Nitrifierande bakterier i akvaponik
Den upplevda balansen mellan pH och nitrifikationseffektivitet har baserats på antagandet att nitrifikationsaktiviteten i akvaponiska system i första hand var en funktion av två olika grupper av bakterier: Nitrosomonas spp., och Nitrobacter spp.
I labbförsök, dessa bakteriearter har visat känslighet för pH, med förändringar i pH som påverkar deras förmåga att oxidera ammoniak (Nitrosomonas) och nitrit (Nitrobacter). Kom ihåg att de flesta nitrifierande bakterier (som studerats hittills åtminstone) inte hanterar förändrade miljövariabler bra. Detta är viktigt att veta av två anledningar:
- Att ändra ditt pH snabbt kommer att minska din nitrifikationseffektivitet.
- De flesta nitrifierare är mycket svåra att ta bort från miljön och kulturen i ett labb.
Varför behöver jag veta detta?
Vad har detta med nitrifikationsdebatten att göra? Väl, Punkt #1 säger oss att kanske många av de "systemkrascher" som tillskrivs att köra ett system-pH för lågt faktiskt kan tillskrivas att systemets pH-värde sänks för snabbt. Punkt #2 säger oss att Nitrosomonas och Nitrobacter kanske inte riktigt är det mest viktiga nitrifierare i system – de är helt enkelt de enklaste grupperna att isolera och odla i en petriskål i ett labb.
Vad betyder det här?
Det betyder i grunden att de hårda och snabba reglerna för nitrifikation kanske inte är så hårda och snabba som de vanligtvis kommuniceras. Det finns många system där ute med mycket låga pH-intervall med stor nitrifikationseffektivitet (inklusive vårt). Det kan vara så att Nitrosomonas och Nitrobacter-arter är de primära nitrifierarna i vårt system, men verkligheten är att vi helt enkelt inte vet. Vad vi vet är att vår nitrifikation är effektiv och utmärkt oavsett vårt system pH.
Nitrifikation i jord
För att sätta detta i perspektiv, det finns många sura jordar och marina miljöer runt om i världen där nitrifikation sker vid anmärkningsvärt låga pH-intervall. Många av nitrifierarna i dessa miljöer är inte medlemmar av Nitrobacter- eller Nitrosomonas-grupperna. Många av dem är okända. I en enda spade jord, det finns uppskattningsvis 10, 000 olika arter av bakterier eller ungefär dubbelt så många bakterier som för närvarande är kända för vetenskapen.
Med det i åtanke, Jag tror att det inte bara är möjligt, men det är troligt att det finns några ganska intressanta bakterier som utför nitrifierande funktioner i akvaponiska system runt om i världen.
Kolla in vår BSA-video som beskriver biologiska ytarea – utan tvekan det viktigaste systemdesignelementet som främjar nitrifikation.
Nitrat
 Hur som helst, slutprodukten är nitrat (NO3-). Vissa växter kan ta upp ammonium och använda det. Dock, de flesta föredrar nitrat. I system där det finns ett överskott av ammonium, växterna kan tendera att bli längare och är ofta mindre säljbara. Å andra sidan, i system med mycket nitrater, problemen med bladlöss och andra skadedjur kan vara mer dramatiska, kräver mer ingripande. Så var medveten om att system med för många nitrater kan se ökade problem med skadedjur.
Hur som helst, slutprodukten är nitrat (NO3-). Vissa växter kan ta upp ammonium och använda det. Dock, de flesta föredrar nitrat. I system där det finns ett överskott av ammonium, växterna kan tendera att bli längare och är ofta mindre säljbara. Å andra sidan, i system med mycket nitrater, problemen med bladlöss och andra skadedjur kan vara mer dramatiska, kräver mer ingripande. Så var medveten om att system med för många nitrater kan se ökade problem med skadedjur.
Nitrat, nitrit, och ammoniaknivåer kan enkelt testas med ett sötvattentestkit, som den här. Nitrat löses i lösningen och tävlas omedelbart om av bakterier, svampar, alger och andra växter. Alla dessa organismer tar upp nitrat och använder det i sina vävnader. Som bakterierna, svampar, och alger dör, att kväve (ofta i form av protein) kommer in i systemet igen och kretsloppet börjar igen. Mycket av nitratet, dock, är levererad, tryggt och säkert, till rotzonen, där växterna i ditt system tar upp det och använder det för att växa.
Idealiska nitratnivåer
Även om det är farligt att ha ammoniak- eller nitritnivåer mycket över 2 ppm respektive 1 ppm, nitrat kan ofta gå långt över 100 ppm (väl utanför diagrammet för många nitrattest) utan att utgöra ett hot mot din fisk. Många hydroponiska system kör nitrat i intervallet 160 ppm. Växter kan ofta uppskatta nivåer ännu högre än så, men den akvaponiska odlaren måste hitta en balans mellan fiskens behov, systemets ekologi (inklusive skadedjur), och växternas behov. Av denna anledning, Jag rekommenderar att de flesta akvaponiska odlare skjuter för att behålla sitt nitrat inom intervallet 40-80 ppm för alltid, konsekvent växttillväxt.
Upprätthålla konsekventa nitratintervall
Många system har svårt att upprätthålla kvävenivåer, speciellt när systemet mognar, växter blir stora och systemekologin blir mer komplex. Detta kan kräva att utfodringen ökas för att möta den ökade efterfrågan. Många människor vill initialt öka beläggningstätheten, men detta är ofta ett misstag. Istället, öka utfodringshastigheten (men övermata inte!), och se om högre nitratnivåer kan uppnås med samma mängd fisk.
Hur man identifierar en kvävebrist

Eftersom kväve är ett mobilt näringsämne (det riktas till olika platser i växten), brister påverkar äldre tillväxt först. Symptomen på en brist är total kloros utan mönster på bladet och hämmad tillväxt. Läs vår nybörjarguide till näringsbrister för mer.
N-P-K
Förutom fiskfoder, kväve kommer in i systemet genom gödningsmedel. Nästan alla gödselmedel har en NPK-klassificering som talar om för dig de relativa koncentrationerna av kväve, fosfor, och kalium (i den ordningen). För vegetativ tillväxt (tillväxt av stjälkar, löv, och rötter), kväve krävs mer än något annat mineralnäringsämne.
Slutsats
På många sätt, kväve är det viktigaste växtnäringsämnet, men också det enklaste. Nästa näringsämne på vår lista är järn - ett petigt näringsämne men viktigt.

 I den mänskliga ekonomins värld, politik, och samhället, det finns många olika valutor, som alla handlas mot varor. Detta kan vara olja, US dollar, Facebook-gilla eller mormors kakor. Den naturliga världen har liknande valutor - handel med syre, kol, och kanske den mest värdefulla valutan av alla: kväve .
I den mänskliga ekonomins värld, politik, och samhället, det finns många olika valutor, som alla handlas mot varor. Detta kan vara olja, US dollar, Facebook-gilla eller mormors kakor. Den naturliga världen har liknande valutor - handel med syre, kol, och kanske den mest värdefulla valutan av alla: kväve . 

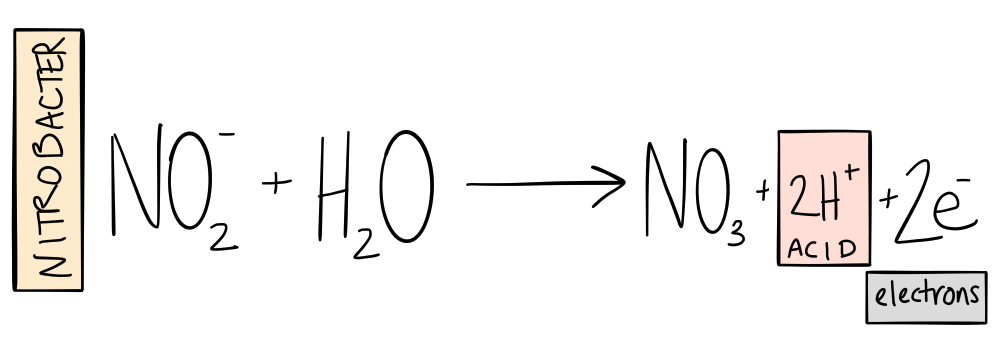
 Hur som helst, slutprodukten är nitrat (NO3-). Vissa växter kan ta upp ammonium och använda det. Dock, de flesta föredrar nitrat. I system där det finns ett överskott av ammonium, växterna kan tendera att bli längare och är ofta mindre säljbara. Å andra sidan, i system med mycket nitrater, problemen med bladlöss och andra skadedjur kan vara mer dramatiska, kräver mer ingripande. Så var medveten om att system med för många nitrater kan se ökade problem med skadedjur.
Hur som helst, slutprodukten är nitrat (NO3-). Vissa växter kan ta upp ammonium och använda det. Dock, de flesta föredrar nitrat. I system där det finns ett överskott av ammonium, växterna kan tendera att bli längare och är ofta mindre säljbara. Å andra sidan, i system med mycket nitrater, problemen med bladlöss och andra skadedjur kan vara mer dramatiska, kräver mer ingripande. Så var medveten om att system med för många nitrater kan se ökade problem med skadedjur. 












